Стандартизация ЛС, Стандарт качества ЛС
Система стандартизации должна предъявлять такие требования к разработке, клиническим испытаниям, производству и реализации ЛС, которые обеспечивали бы максимальную их безопасность, требуемое фармакологическое действие и гарантированное качество на всех этапах их применения.
В общем случае, такие требования наиболее полно отражены в требованиях GLP (Good Laboratory Practice), GCP (Good Clinical Practice) и GMP (Good Manufacturing Practice), являющиеся частными случаями международных стандартов ИСО 9000 и регламентирующих доклинические и клинические испытания, производство и реализацию ЛС. Отметим, что в USP XXIII также приведены требования GMP для ЛС. В настоящее время в Украине подготовлены отечественные требования GMP.
Переход на требования GLP, GCP и GMP требует достаточно высокой культуры производства и больших материальных затрат. В тех странах, где по каким-то причинам еще не сложились условия для полного перехода на эти требования, при создании системы стандартизации ЛС используются их основные элементы.
1. Реализоваться могут только те ЛС, которые разрешены к медицинскому применению и реализации в данной стране.
стандартизация сертификация лекарственное средство
2. Реализовываться могут только те ЛС, на которые имеется утвержденная или согласованная соответствующим государственным органом аналитическая нормативно-техническая документация (НТД).
3. НТД должна обеспечивать объективный контроль качества ЛС, получаемого по данной технологии. В общем случае, конкретная НТД может обеспечивать объективный контроль ЛС, полученного только по конкретной технологии.
- Уровень производства должен обеспечивать возможность получения ЛС с показателями качества, заложенными в НТД.
- Система контроля качества реализуемых ЛС должна обеспечивать возможность выявления брака.
Пункт 3 означает, что по одной и той же НТД, в общем случае, нельзя контролировать ЛС, получаемые по разным технологиям. Например, в некоторой технологической схеме получения субстанции парацетамола не используются органические растворители, поэтому в разработанной для данной технологии НТД они не контролируются. Если разрабатывается новая технология получения парацетамола, в которой используется, например, бензол, то очевидно, что по прежней НТД его качество контролировать нельзя. Необходимо добавочно ввести контроль остаточных количеств бензола. Аналогичная ситуация возникает и с контролем технологических примесей, которые могут быть существенно разными для разных технологий. Поэтому действующая НТД, в общем случае, может контролировать только ту технологию, на основе которой она была разработана. Любые изменения технологии могут потребовать корректировки требований НТД.
Договор как средство определения требований к качеству товаров, работ и услуг
... неустойку за просрочку. Недействительность условий договора, ущемляющих права потребителя. Действие Закона распространяется ... потребителю товар (результат выполнения работы, оказать услугу), качество которого соответствует обязательным требованиям государственных стандартов, условиям договора, ... договора. Внедоговорную ответственность, по общему правилу, влечет обязательство, возникшее не из договора, ...
К сожалению, требования пункта 3 очень часто недопонимаются и недооцениваются. Типичная ситуация: в Украину ввезли импортную субстанцию (парацетамол), технология производства которой была неизвестна, проконтролировали ее по действующей НТД и на основании этого сделали вывод о качестве данной субстанции. Очевидно, этого мало. Поскольку технология неизвестна, то неизвестны остаточные растворители, технологические примеси, которые могут не контролироваться вышеуказанными НТД. Если необходимость в ввозе данной субстанции существует, то обязательно следует провести дополнительные (прежде всего, хроматографические) исследования. Аналогично обстоит дело и с готовыми ЛС.
Пункт 4 означает, что далеко не на каждом фармацевтическом предприятии может производиться данное ЛС. Например, для производства инъекций нужны особые требования к чистоте, оборудованию, персоналу. В противном случае получить качественный препарат в принципе невозможно.
Пункт 5 характеризует взаимоотношения производителей и потребителей. Система контроля качества должна обеспечивать поддержание производителями соответствующего уровня производства, выполнения ими требований НТД и регламентов, а также возможность выявления случайного брака и фальсификации. Последнее особенно важно для сильнодействующих и жизненно важных ЛС.
В мировой практике одним из важнейших документов, определяющим требования к производству и контролю качества лекарственных средств для человека и животных, являются «Правила производства лекарственных средств» — «Good Manufacturing Practice for Medicinal Products (GMP)».
Они направлены на обеспечение высокого уровня качества и безопасности лекарственных средств и гарантирование того, что лекарственное средство изготовлено в соответствии со своей формулой (составом), не содержит посторонних включений, маркировано надлежащим образом, упаковано и сохраняет свои свойства в течение всего срока годности.
Правила GMP устанавливают требования к системе управления качеством, контролю качества, персоналу, помещениям и оборудованию, документации, производству продукции и проведению анализов по контрактам, рекламациям, порядку отзыва продукции и организации самоинспекций.
Настоящий стандарт устанавливает требования к производству и контролю качества лекарственных средств для человека и животных.
Стандарт распространяется на все виды лекарственных средств и устанавливает общие требования к их производству и контролю качества, а также специальные требования к производству отдельных видов лекарственных средств.
В целях развития системы стандартизации в здравоохранении и совершенствования функционирования сферы обращения лекарственных средств было призвано утвердить и ввести в действие с 30 марта 2003 года Отраслевой стандарт ОСТ 91500.05.0007-2003 «Правила отпуска (реализации) лекарственных средств в аптечных организациях. Основные положения».
Фальсификация лекарственных средств
... №61 «Об обращении лекарственных средств». Согласно закону, «фальсифицированное лекарственное средство - это лекарственные средства, сопровождаемое ложной информацией о его составе и (или) производителе» [5]. 3. Современное состояние проблемы Проблема фальсификации лекарственных средств актуальна сегодня во ...
С 1 июля 1973 года (редактирован 1 января 1974 года) был введен и утвержден ОСТ 42-2-72 «Лекарственные средства. Порядок установления сроков годности» и действителен по сей день. Несоблюдение стандарта преследуется по закону. Настоящий стандарт регламентирует единый порядок установления сроков годности лекарственных средств, обязательный для всех предприятий и организаций, изготавливающих или разрабатывающих лекарственные средства, независимо от их территориального расположения и ведомственной принадлежности.
Минздравом РФ от 29 декабря 1998 г был утвержден ОСТ 42-511-99 «Правила проведения качественных клинических испытаний в РФ» Настоящий стандарт устанавливает требования к проведению клинических испытаний лекарственных средств.
Правила проведения качественных клинических испытаний в Российской Федерации (Good Clinical Practice — GCP) представляют собой этический и научный стандарт качества планирования и проведения исследований на человеке, а также документального оформления и представления их результатов.
Соблюдение этих правил служит гарантией достоверности результатов клинических испытаний, безопасности, охраны прав и здоровья испытуемых в соответствии с основополагающими принципами Хельсинкской декларации.
Кроме того, принципы Правил могут быть распространены на другие клинические исследования, при проведении которых нельзя исключить нежелательное влияние на безопасности и здоровье человека.
К известному списку за последнее время прибавилось еще некоторое количество нормативных документов, таких как:
- Постановление Правительства РФ от 29 сентября 2010 г. N 771 «О порядке ввоза лекарственных средств для медицинского применения на территорию Российской Федерации» (с изменениями от 3 июня 2011 г.)
- Федеральный закон от 12 апреля 2010 г. N 61-ФЗ «Об обращении лекарственных средств»
— Приказ Министерства здравоохранения и социального развития РФ от 27 августа 2010 г. N 767 «Об организации приема и передачи документов, связанных с государственной регистрацией лекарственных средств, выдачей разрешений на проведение клинических исследований лекарственных средств, разрешений на ввоз (вывоз) биологических материалов, государственной регистрацией предельных отпускных цен на лекарственные средства, находящихся в документообороте Федеральной службы по надзору в сфере здравоохранения и социального развития, государственного реестра лекарственных средств, государственного реестра предельных отпускных цен производителей на жизненно необходимые и важнейшие лекарственные средства.» и др.
1. Стандартизация ЛС.
На всех этапах создания и использования ЛС контроль его качества осуществляют: отдел технического контроля предприятия-изготовителя (ОТК), заводские лаборатории, контрольно-аналитические лаборатории, в аптеке — провизоры-аналитики.
Государственная система контроля качества ЛС носит название контрольно-разрешительной системы Минздрава России, которая включает две структурные единицы:
Административная деятельность органов внутренних дел в системе ...
... работа, осуществляются контроль и надзор за ходом ее выполнения. Подчиненность и подконтрольность административной деятельности органов внутренних дел соответствующим федеральным органам государственной власти, органам государственной ... изучение административной деятельности органов внутренних дел.1 Цель данной курсовой работы: исследование основ и особенностей административной деятельности органов ...
- Департамент государственного контроля качества ЛС и медицинской техники (Департамент);
- Управление обеспечения лекарствами и медицинскими изделиями (Управление).
Одна из функций Департамента — регистрация ЛС. Регистрации и перерегистрации подлежат новые ЛС (субстанции, монопрепараты, комплексные препараты); новые комбинации ЛС, зарегистрированных ранее; ЛС, зарегистрированные ранее, но произведенные в новых лекарственных формах, с новой дозировкой или с другим составом вспомогательных веществ; воспроизведенные ЛС («дженерики») и т.д.
После прохождения будущими ЛС доклинических испытаний составляется проект Фармакопейной статьи. Проект ФС и отчет по доклиническим испытаниям подаются в Департамент. Экспертизу материалов осуществляет созданный при Департаменте Научный центр экспертизы и Государственного контроля качества, в который входит ряд институтов и комитетов.
После экспертизы регистрационных документов Президиум Фармакопейного комитета рекомендует ФС к регистрации, которая осуществляется Департаментом государственного контроля.
После проведения доклинических испытаний и утверждения ФС назначаются клинические испытания ЛС. После их завершения Фармакологический комитет принимает решение об утверждении ЛС.
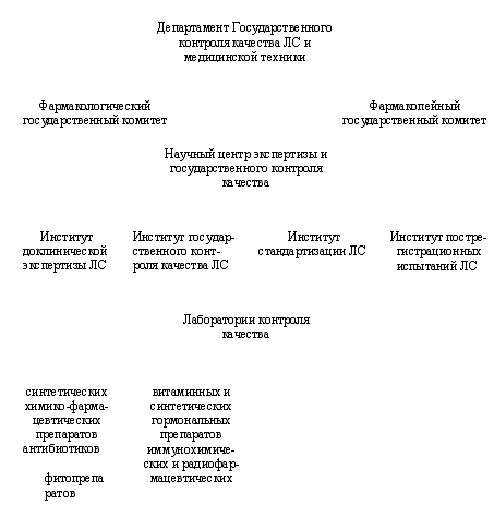
Государственная система контроля качества лекарственных средств
2. Государственный контроль качества.
После регистрации ЛС проходит Государственный контроль качества.
Контроль качества ЛС
Государственная система контроля качества ЛС устанавливает нормы качества лекарственных и вспомогательных веществ, используемых в производстве лекарственных препаратов, которые включаются в нормативно-техническую документацию — фармакопейная статья, фармакопейная статья предприятия, Государственная Фармакопея, ГОСТы.
Предварительному контролю подлежат ЛС, которые впервые разрешены к медицинскому применению; впервые выпускаемые данным предприятием; выпускаемые по измененным технологиям; переведенные Департаментом на этот вид контроля (при определенном числе бракованной продукции).
При проведении Государственного контроля в Департамент направляют образцы субстанций и аналитических паспортов качества первых пяти промышленных серий ЛС. Государственный контроль проводит Институт государственного контроля качества ЛС по утвержденным нормативным документам (НД).
Институт дает рекомендацию на последующий (выборочный) контроль. Арбитражный контроль проводят при разногласиях по качеству между производителем и покупателем. Это относится как к российским, так и к зарубежным ЛС.
- Сертификация ЛС.
Сертификации подлежат ЛС серийного производства, выпускаемые предприятиями различных форм собственности, а также ввозимые из-за рубежа.
Сертификация ЛС
Сертификация ЛС включает: сертификацию производства (соответствие правилам GMP); сертификацию ЛС.
Центральный орган по сертификации ЛС — это федеральное государственное учреждение — Центр сертификации ЛС Минздрава России. В структурную схему сертификации входят также территориальные органы по сертификации ЛС, контрольные лаборатории.
Проблемы рекламы лекарственных средств
... улучшения ситуации с законодательным регулированием рекламы лекарственных средств не приходится. Общепринятые международные требования по проведению рекламы лекарственных средств В мае 1988 года ... рекламе лекарственных средств, более четко регламентировать порядок применения санкций к нарушителям законодательства о рекламе, поскольку существующий на сегодняшний день механизм контроля за рекламой ...
На территории России введен сертификат соответствия ЛС единого образца, который выдается органом по сертификации сроком на 1 год.
После проверки по показателям «Описание», «Упаковка» и «Маркировка» обязательному контролю по всем показателям подлежит большая группа лекарственных средств и вспомогательных веществ, используемых или изготовляемых в аптеках. Кроме того, полному контролю подлежат психотропные средства (субстанции и лекарственные формы); Л С для наркоза, в том числе инъекционные, за исключением кислорода и закиси азота (оксида азота (1) N 2 О); все лекарственные формы для детей; препараты инсулина; рентгеноконтрастные средства.
Информация о случаях выявления брака сообщается на предприятие-производитель, поставщику и в Департамент.
Роль международных стандартов в государственной системе управления качеством ЛС., Государственная Фармакопея
Отечественная нормативная документация принимает во внимание международные стандарты: требования, изложенные в документах ВОЗ, Международной, Европейской, национальных Фармакопеи — США, Японии и других экономически развитых стран.
Тесное политическое и экономическое сотрудничество государств, и, в первую очередь, сотрудничество государств в рамках Евросоюза, способствовало тому, что большинство европейских стран присоединились к Европейской фармакопее. Таким образом, большинство европейских стран осуществляют стандартизацию лекарственных средств на основе требований Европейской Фармакопеи (ЕФ).
Среди них — Австрия, Бельгия, Босния, Герцеговина, Дания, Германия, Греция, Венгрия, Ирландия, Исландия, Испания, Италия, Кипр, Люксембург, Македония, Нидерланды, Норвегия, Португалия, Словакия, Словения, Турция, Финляндия, Франция, Хорватия, Чешская Республика, Швеция. В Комиссию ЕФ входят 18 наблюдателей, включая ВОЗ — Европейские государства: Албания, Латвия, Литва, Польша, Румыния, Украина, Эстония, неевропейские государства: Алжир, Австралия, Канада, Китай, Малайзия, Марокко, Сирия, Тунис.
Объединение государств способствует унификации требований при создании и контроле качества лекарственных средств. Это важно в настоящий период, когда для ЛС практически нет границ. В такой ситуации критерии контроля качества должны быть едины во всех государствах. Россия, будучи евразийским государством, не должна идти «своим» путем. Первые действия в этом направлении уже сделаны: на отечественных фармацевтических предприятиях активно внедряются правила GMP, обязательные для Европейской Фармакопеи.
Перспективы Европейской Фармакопеи
Директорат Европейской Фармакопеи в целях координации действий различных государств Европы и Азии в области научного и технологического фармацевтического анализа регулярно проводит симпозиумы, совещания, конференции, а также издает информационные материалы, которые представляют интерес для специалистов, работающих в области контроля качества ЛС, различных лицензионных организаций, фармакопейных комитетов, представителей ВОЗ, промышленных фармацевтических предприятий и университетов. Такая политика помогает отработать стратегию поведения на всех уровнях создания и контроля качества лекарств. Это позволяет обеспечить пациенту (человеку или животному) гарантию того, что отдельно введенная доза будет обладать идентичным химическим составом, а токсикологические, фармакологические и фармакотерапевтические исследования ЛС — соответствовать требованиям стандарта.
Организация хранения лекарственных средств в аптечных организациях
... порчи и потери качества следует организовать хранение лекарственных средств в соответствии с ... в соответствии с требованиями государственной фармакопеи и нормативной документации. Фармацевтические субстанции ... хранения особо чувствительных к свету фармацевтических субстанций (нитрат серебра, прозерин) стеклянную тару оклеивают черной светонепроницаемой бумагой. Лекарственные препараты для медицинского ...
Рассматриваются теоретические и практические проблемы разработки стандартов качества лекарственных средств, новые методы, применяемые в настоящее время в фармацевтическом анализе: хроматографические, электрофоретические, кругового дихроизма для определения примесей энантиомеров (оптических изомеров), ближняя ИК-спектрометрия, рамановская спектрометрия (спектрометрия комбинационного рассеяния, позволяющая в отличие от ИК-метода работать с водными растворами ЛС и используемая для идентификации оптических изомеров).
Подчеркнута важность контроля качества ЛС на отдельных технологических стадиях его получения. Именно такой подход обеспечивает надлежащее качество конечного продукта.
Показана необходимость создания новых фармакопейных статей на все вспомогательные вещества, методики разделения и валидации отдельных методов анализа. Фармакопейная статья на вспомогательные вещества должна включать разделы: Описание, Получение, Характеристика, Подлинность, Количественное определение, Упаковка.
Планируется внести изменения в ФС для воды: получение ее обратным осмосом; строгий контроль эндотоксинов.
дискуссии о роли метрологии
1. Государственный научный центр лекарственных средств (ГНЦЛС).
Госкоммедбиопром «Технология и стандартизация лекарств», Х: ООО Рирег, переизд. 2005, 779 с.
2. Министерство здравоохранения Украины. Национальная академия наук Украины. Государственный научный центр лекарственных средств «Технология и стандартизация лекарств (том 2)», Х: ООО Рирег, переизд. 2005, 782 с.
3. Н. Тюкавкина «Стандартизация и контроль качества лекарственных средств»
4. . htm <http://www.medtran.ru/rus/trials/gost/52249-2004.htm>
- http://truddoc. narod.ru/sbornic/medoosmotri/51. htm <http://truddoc.narod.ru/sbornic/medoosmotri/51.htm>
- .
php? option=com_content&view=article&id=463%3Aost42-2-72&catid=31%3Adrugs&Itemid=36&lang=en&limitstart=1 <http://www.consultpharma.ru/index.php?option=com_content&view=article&id=463%3Aost42-2-72&catid=31%3Adrugs&Itemid=36&lang=en&limitstart=1>
- . php? id=7 <http://medicalarea.ru/index.php?id=7>
- .
htm <http://rudoctor.net/medicine/bz-jw/med-kmhab/index.htm>
9. Документы с использованием базы http://www.garant.ru/doc/law/
